在元素周期表中,物理及化学性质相似或相同有什么规律
1、在元素周期表中,同一竖行(主族元素)的化学性质相似:金属元素从上到下活泼性增强,非金属元素活泼性减弱。 物理性质也呈现规律:金属元素从上到下熔点降低,非金属元素的熔点和沸点升高。 同一横行(周期)的元素化学性质和物理性质均呈现变化:从左到右金属性减弱,非金属性增强。
2、化学性质相似的元素是指最外层电子数相等的元素,因为它们在化学反应中得失电子的情况相同。 通常,同一列的元素在元素周期表中具有相似的化学性质,例如Li、Na、K、Be、Mg和Ca。
3、电子排布规律:在元素周期表中,同一族的元素具有相似的电子排布,特别是最外层电子数相同。这一特点决定了它们在化学反应中的行为方式。价电子与化学键:最外层电子(也称价电子)是参与化学反应的主要电子。
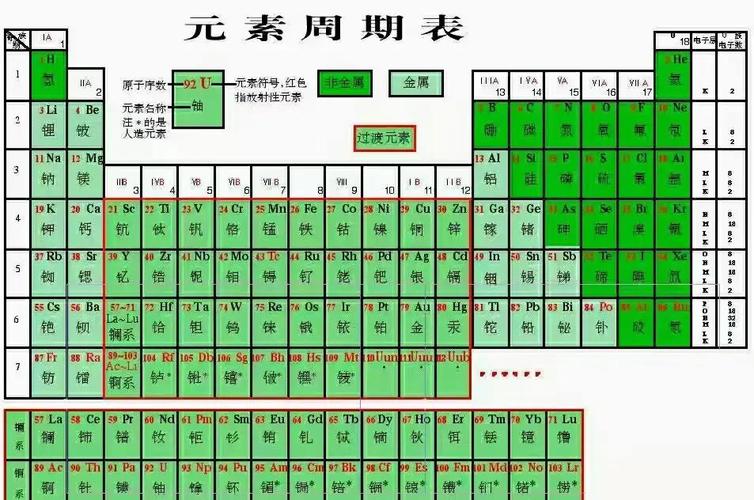
4、元素周期表同一纵行的规律如下:化学性质相似:同一纵行的元素属于同一族,具有相同的最外层电子数,这是它们化学性质相似的基础。原子半径增大:在同一族中,随着电子层数的增加,原子半径也随之增大。这是由于电子层数的增加导致电子与原子核之间的距离增大。
5、从左到右,同一周期的元素原子的电子层数相同,而最外层电子数依次递增。这使得元素的化学性质从左到右呈现出一定的递变规律,例如金属性逐渐减弱,非金属性逐渐增强。
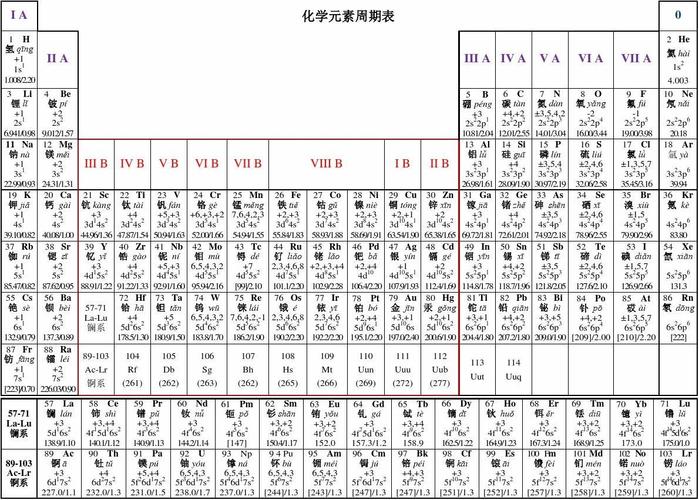
6、元素的化学性质主要与其电子结构有关。元素的原子核中包含着不同数量的质子和中子,而电子则围绕着原子核运动形成电子壳层。具有相似电子结构的元素往往会表现出类似的化学性质。位于同一元素周期表列的元素,它们的最外层电子数目相同,因此它们在化学反应中的行为相似。
元素周期表金属性非金属性规律是什么?
1、在元素周期表中,金属性和非金属性的规律体现在如下方面: 同周期内,从左至右,元素的金属性逐渐减弱,非金属性逐渐增强。 同主族中,从上至下,元素的金属性逐渐增强,非金属性逐渐减弱。 在周期表的左下角,铯是金属性最强的元素;而在右上角,氟是非金属性最强的元素。
2、元素周期表中,金属性和非金属性的规律体现在以下几个方面: 原子半径的变化:从左至右,周期表上的原子半径逐渐减小,而由上至下,原子半径则逐渐增大。
3、元素周期表金属性非金属性规律如下:原子半径由左到右依次减小,上到下依次增大。除第1周期外,其他周期元素(稀有气体元素除外)的原子半径随原子序数的递增而减小;同一族的元素从上到下,随电子层数增多,原子半径增大。
4、元素周期表金属性非金属性规律是:(1)同一周期,从左到右金属性减弱,非金属性增强。同一主族从上到下金属性增强,非金属性减弱。金属性最强的位于左下角的铯,非金属性最强的是位于右上角的氟。(2)金属性越强单质越容易跟水或酸反应置换出氢,对应的最高价氧化物水化物碱性越强。
元素周期表中原子半径规律
1、原子半径由左到右依次减小,上到下依次增大。同一周期内,从左到右,元素核外电子层数相同,最外层电子数依次递增,原子半径递减(零族元素除外)。失电子能力逐渐减弱,获电子能力逐渐增强,金属性逐渐减弱,非金属性逐渐增强。同一族中,由上而下,最外层电子数相同,核外电子层数逐渐增多,原子半径增大,原子序数递增,元素金属性递增,非金属性递减。
2、原子半径的规律十分有趣,它揭示了元素周期表中元素之间的重要关系。通常情况下,除了第一周期外,其他周期的元素(不包括稀有气体)的原子半径会随着原子序数的增加而逐渐减小。这是因为随着原子序数的增加,核电荷数也相应增加,吸引电子的力量增强,导致原子半径减小。
3、原子半径的规律:除第1周期外,其他周期元素(稀有气体元素除外)的原子半径随原子序数的递增而减小;同一族的元素从上到下,随电子层数增多,原子半径增大。
4、在元素周期表中,原子半径的判断遵循以下规律(1)对于第1周期以外的元素,随着原子序数的增加,原子半径通常会减小,但惰性气体元素例外;(2)在同一族中,元素的原子半径会随着电子层数的增加而增大,从上至下递增。对于离子,当核外电子排布相同时,核电荷数较高的离子其半径会更小。
5、同一周期,随原子序数的递增,原子半径由大到小(稀有气体除外)同一主族,随原子序数的递增,原子半径由小到大 同一周期原子序数的递增第一电离能逐渐增大,同一主族第一电离能逐渐减小。
高中化学:有关元素周期表氧化性,金属性等排序
1、非金属性:逐渐减弱。非金属原子获得电子的能力随着原子半径的增大而减弱。 氧化性:单质的氧化性逐渐减弱。非金属性减弱,原子获得电子成为负离子的趋势减小。 还原性:单质的还原性逐渐增强。金属性增强,原子失去电子成为正离子的趋势增加。 最高价氧化物对应水化物的酸碱性:碱性逐渐增强,酸性逐渐减弱。
2、金属阳离子的氧化性顺序与金属活动顺序表相反,即排在后面的金属阳离子氧化性越强。具体顺序为:银离子(Ag+) 铁离子(Fe3+) 铜离子(Cu2+) 氢离子(H+)等。化合物的氧化性强弱与溶液的pH值有很大关系,因此在实际应用中需要综合考虑多种因素。
3、钾、钙、钠、镁、铝、锌、铁、锡、铅、(氢)、铜、汞、银、铂、金 元素的金属性是指元素的原子失电子能力,判断元素金属性强弱,主要可从以下几方面来判断。依金属活动顺序表判断 金属活动顺序表中,一般位置越后的金属,金属性越弱,原子的还原性越弱。
4、第二周期:(单质氧化性)N2O2F2;(元素非金属性)NOF 第三周期:(单质氧化性)SiPSCl2;(元素非金属性)SiPSCl 同主族(竖行,从上到下)元素非金属性递减,单质氧化性递减。
本文来自作者[admin]投稿,不代表传腾贝立场,如若转载,请注明出处:https://ctbia.cn/zlan/202511-739.html



评论列表(3条)
我是传腾贝的签约作者“admin”
本文概览:在元素周期表中,物理及化学性质相似或相同有什么规律 1、在元素周期表中,同一竖行(主族元素)的化学性质相似:金属元素从上到下活泼性增强,非金属元素活泼性减弱。 物理性质也呈现规...
文章不错《元素周期表规律(元素周期表规律电负性)》内容很有帮助